Hallo liebe Freunde der Mikrokristalle,
in meinem letzten Blogbeitrag habe ich das Natriumcarbonat vorgestellt. Man kann damit recht schöne Mikrokristalle erzeugen, die aber farblich nicht sehr viel hergeben.,
Ganz anders sieht es mit Natriumacetat aus. Mit diesem Salz lassen sich fantastisch farbige Mikrokristalle erzeugen. Wir können uns Natriumacetat relativ leicht selber herstellen. Dazu benötigen wir an Chemikalien nur das Natriumcarbonat aus dem vorigen Blogbeitrag und Essig aus der Küche. (Der saure Bestandteil des Essigs ist Essigsäure).
Für chemisch weniger bewanderte Leser einige Erläuterungen: Natriumcarbonat ist das Salz einer starken Lauge, nämlich der Natronlauge und einer sehr schwachen Säure, der Kohlensäure.
Wenn man dem Salz einer schwachen Säure eine stärkere Säure zusetzt, verdrängt die stärkere Säure die schwache. Genau das wollen wir durchführen. Essigsäure ist eine viel stärkere Säure als Kohlensäure und verdrängt diese sehr leicht. Aus dem Natriumcarbonat wird Natriumacetat.
Folgende Gerätschaften werden benötigt:
- Feuerfeste flache Schale aus Porzellan oder Metall (kein Aluminium oder Kupfer).
- Teelöffel
- Kleiner Filtertrichter
- Kaffeefilterpapier
- Becherglas oder Schnapsglas
Chemikalien:
- Natriumcarbonat (Soda)
- Speiseessig
- Brennspiritus oder Isopropanol
Wer keine feuerfeste Schale besitzt kann auch eine kleine Glasschale verwenden, muss dann aber das Lösungsmittel ohne Wärmezufuhr verdunsten lassen, was einige Tage benötigt.
So, und nun geht es los: In die feuerfeste Schale geben wir einen gestrichenen Teelöffel Natriumcarbonat. Jetzt fügen wir ganz langsam Essig hinzu. Das Natriumcarbonat schäumt stark auf. Das rührt daher, dass die Essigsäure die Kohlensäure aus dem Natriumcarbonat austreibt. Die Kohlensäure zerfällt, da instabil, sofort zu Wasser und Kohlendioxid, das als Gas entweicht. Wir geben so lange in kleinen Portionen Essig zu, bis keine Gasbildung mehr sichtbar ist. (Ein kleiner Überschuss an Essig schadet nicht). Wir haben jetzt eine klare Lösung vorliegen, die bereits unser Natriumacetat enthält. Aber wir sind noch nicht fertig mit unserer Arbeit. Der Speiseessig enthält meist noch Zutaten wie z.B. Gewürze und andere Zusatzstoffe. Diese Dinge wollen wir entfernen, da besonders das reine Natriumacetat sehr schön kristallisiert.
Wir stellen unsere feuerfeste Schale auf eine Herdplatte und lassen das Wasser langsam verdampfen. (Es geht auch bei Raumtemperatur, benötigt aber eine knappe Woche). Zum Schluss bitte aufpassen, es kann sehr leicht spritzen, Schutzbrille tragen, darum die Schale rechtzeitig von der Herdplatte nehmen. Die Eindampftemperatur sollte 100°C nicht überschreiten! (Wenn es etwas gespritzt hat, kein Problem, mit einem feuchten Lappen von der Herdplatte entfernen. Hier ist nichts giftig). Wir haben jetzt einen weißen bis leicht gelblichen Rückstand in unserer Schale, das Natriumacetat. Um es von Verunreinigungen und restlicher Essigsäure zu befreien, geben wir ca. 20 ml (ein Schnapsglas) Spiritus hinzu und lösen den Kristallbrei vom Schalenboden. Eventuelle Würzextrakte und Essigsäure lösen sich im Spiritus. Das Natriumacetat ist aber in dem Lösungsmittel nur sehr wenig löslich.
Wir schneiden uns ein kreisrundes Filter aus einem Kaffeefilter und falten es einmal, so dass es einen Halbkreis bildet. Den falten wir nochmal zu einem Viertelkreis. Jetzt können wir den Viertelkreis zu einer Filtertüte öffnen, die wir in den Filtertrichter einsetzen. Wir feuchten das Papierfilter mit Spiritus an, damit es gut an der Trichterwand anliegt. Jetzt befördern wir den Filterbrei mit dem Spiritus in das Filter, das wir in ein Glasgefäß stellen, damit der Spiritus dort hineinlaufen kann. Wenn der Spiritus abgelaufen ist, waschen wir noch mit etwas Spiritus nach.
Wir haben jetzt im Filter praktisch reines, weißes Natriumacetat, das wir nur noch trocknen müssen. Das geht am besten in der eingangs verwendeten Schale an der Luft in staubarmer Umgebung.
Das trockene Natriumacetat bewahren wir in einer kleinen Flasche oder Plastiktüte auf. (Beschriften nicht vergessen). Eine Warnung zum Spiritus: Spiritus ist fast reiner Alkohol, der mit einer extrem bitter schmeckende Substanz vergällt ist, damit man ihn nicht trinken oder zu alkoholischen Getränken verarbeiten kann. Er ist daher auch steuerfrei und preiswert. In der Küche sollte man mit Spiritus vorsichtig umgehen, damit nicht Gefäße oder Tischoberflächen oder Wischlappen den bitteren Geschmack annehmen! Viel besser geeignet ist an Stelle von Spiritus Isopropanol der korrekt 2-Propanol genannt wird. Also, immer sauber arbeiten und hinterher alles gut abwaschen. Spiritus ist feuergefährlich! Niemals mit offener Flamme arbeiten. Auch in der Nähe darf kein offenes Feuer sein!
Hier noch kurz die formelmäßige Beschreibung:
Na2CO3 + 2 CH3COOH = 2 CH3COONa + CO2 + H2O
Beim Kristallisieren des Natriumacetats gibt es eine Besonderheit: Natriumacetat kristallisiert zusammen mit 3 Molekülen Kristallwasser. Formal können wir schreiben: CH3COONa⋅3H2O. Dieses sogenannte Trihydrat löst sich bei 58°C im eigenen Kristallwasser. Bei ca. 120°C beginnt das Kristallwasser zu verdampfen. Das wasserfreie Salz schmilzt bei ca. 300°C. Darum muss man beim Eindampfen aufpassen, dass die Temperatur 120ºC nicht überschreitet. Es ist aber auch kein Problem, wenn man das wasserfreie Natriumacetat herstellt. Auf dem Objektträger entsteht ohnehin bei Wasserzugabe wieder das Trihydrat.
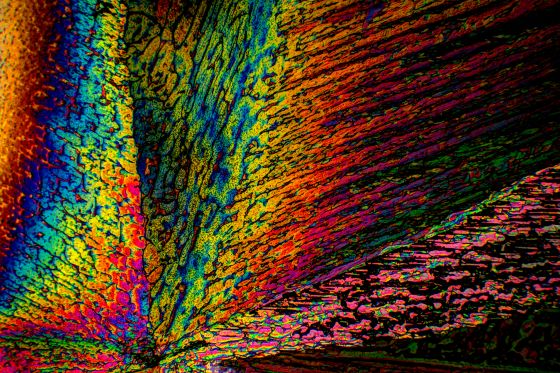
Es gibt eine weiter Besonderheit des Natriumacetats, die wir auf dem Objektträger beobachten können: Dazu geben wir einige Körnchen unseres Salzes auf einen sauberen Objektträger. Wir fügen einen Tropfen eines Lösungsmittels Spiritus/dest. Wasser 1:1 hinzu. Die Körnchen lösen sich leicht auf, eventuell mit einem Glasstab oder dem Stiel eines Teelöffels etwas verteilen. Bei Zimmertemperatur, (nicht auf der Heizung!!) das Lösungsmittel verdunsten lassen. Nachdem das Lösungsmittel verdunstet ist liegt auf dem Objektträger eine nicht kristalline Masse vor. Wenn man diese, z.B. mit einer Stecknadel, berührt oder etwas ankratzt, erfolgt eine spontane Kristallisation. Man kann auch ganz wenig Natriumacetat zwischen den Fingern ganz fein verreiben und wenige Körnchen, ein einziges würde genügen, auf den Objektträger geben. Sofort erfolgt spontane Kristallisation. Natriumacetat bildet gerne sogenannte unterkühlte Schmelzen, die dann bei Berührung oder Erschütterung kristallisieren. Die so entstandenen Kristalle ergeben sehr schöne Bilder im polarisierten Licht, wie die folgenden Aufnahmen zeigen:
Vergleicht man die Kristalle von Natriumcarbonat mit denen von Natriumacetat, so sieht man, dass letztere viel farbiger sind. Ich vermute dafür folgenden Grund: Voraussetzung für bunte Strukturen im polarisierten Licht ist der anisotrope Charakter der Kristalle. (Den Begriff der Anisotropie habe ich in meinem Blogbeitrag Warum ergeben Mikrokristalle im polarisierten Licht farbige Bilder? ausführlich beschrieben). Ein Natriumcarbonat-Kristall ist vermutlich symmetrischer aufgebaut, als ein Natriumacetat-Kristall und besitzt daher geringere anisotrope Eigenschaften. Aber das ist nur eine Vermutung von mir. Das Kristallwasser befindet sich nicht irgendwo eingeschlossen im Kristall, es ist im Kristallgitter eingebaut.
Die Eigenschaft von Natriumacetat, unterkühlte Schmelzen zu bilden, nutzt man in Wärmespeichern, die man im Winter als Sitzkissen benutzen kann. Diese Wärmespeicher bestehen aus einer Kunststoffhülle, die Natriumacetat enthält. Zusätzlich befindet sich darin ein Metallstreifen. Zu Hause erwärmt man das Sitzkissen auf ca. 60°C. Dabei lösen sich die Kristalle unter Wärmeaufnahme im eigenen Kristallwasser. Dieses Kissen kann man jetzt abkühlen lassen. Wenn man die gespeicherte Kristallisationswärme nutzen will, knickt man das Kissen an der Stelle, wo der Metallstreifen sitzt. (Entspricht dem Anritzen auf dem Objektträger). Jetzt kristallisiert das Natriumacetat und setzt die Kristallisationswärme frei. Das Sitzkissen erwärmt sich auf ca. 35°C.
Wer sich lieber Natriumacetat kaufen möchte, bekommt es preiswert bei Amazon. Dort gibt es auch meinen Kalender „Surreale Farbwelten – Mikrokristalle“ für 2017 mit tollen Mikrokristallen.
Soviel für heute, liebe Freunde der Mikrokristalle. Im nächsten Blogbeitrag vergleiche ich Bilder der Zitronensäure mit Natriumzitrat, dem Natriumsalz der Zitronensäure, das wir auch leicht selber herstellen können.
Bis dahin wünsche ich eine gute Zeit.
H-D-S
Titel: Surreale Farbwelten-Mikrokristalle
Autor: Dieter Schenckenberg
Hier die ISBN-Nummern:
Wandkalender 2017 DIN A4 quer ISBN 978-3-664-84126-4
Wandkalender 2017 DIN A3 quer ISBN 978-3-664-84127-1
Wandkalender 2017 DIN A2 quer ISBN 978-3-664-84128-8
Den Kalender gibt es bei