Hallo liebe Freunde der Mikrokristalle,
in meinem letzten Blogbeitrag wandelten wir auf den Spuren Erst Abbes, um das Auflösungsvermögen optischer Mikroskope zu erkunden. Über das Beugungsverhalten von Lichtwellen an einem Gitter kamen wir zu der Gleichung
x ≥ λ/NA (1)
mit x als dem kleinsten Abstand zwischen 2 Punkten, die gerade noch scharf abgebildet werden können,
λ der Wellenlänge der Beleuchtung und
NA, der von Ernst Abbe eingeführten Numerischen Apertur.
Es gibt aber noch einen anderen Weg, x zu berechnen, der am Ende zu einem ähnlichen Resultat kommt. Er führt über das Rayleigh Kriterium. Wir erinnern uns: Durch den Wellencharakter des Lichts wird ein Lichtpunkt, nicht als Punkt, sondern als Beugungsscheibchen auf einem Bildschirm abgebildet. Zur Demonstration habe ich das Licht eines roten Laser Pointers durch eine enge Blende geleitet und auf einem Bildschirm aufgefangen und fotografiert.

Beugungsbild eines roten Laserpointers.
Man nennt die Beugungsscheibchen auch Rayleigh-Scheibchen nach dem englischen Gelehrten John William Strutt, 3. Baron Rayleigh. Seine Beugungstheorie will ich hier kurz darstellen:
Betrachten wir die folgende Skizze:
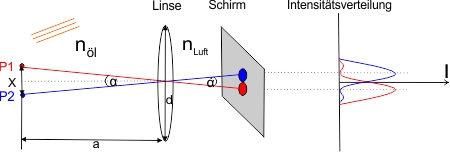
Zwei Punkte P1 und P2 fallen unter einem Winkel ∝ durch eine Linse, mit dem Durchmesser d auf einen Schirm. Das umgebende Medium links von der Linse sei Immersionsöl mit dem Brechungsindex nöl. Rechts von der Linse haben wir den Brechungsindex nLuft und den Winkel ∝’, der sich von ∝ wegen der unterschiedlichen Brechungsindizes unterscheidet. (Ist in der Skizze nicht ganz korrekt gezeichnet). Auf dem Bildschirm, er entspricht dem Zwischenbild im Mikroskop, werden die Punkte gerade noch getrennt als Beugungsscheibchen abgebildet. Die Kurven rechts zeigen die Intensitätsverteilung I des Lichts bei den beiden Beugungsscheibchen. In der Mitte, auf den gestrichelt dargestellten Linien, liegen die Beugungsmaxima 0. Ordnung. Das sind die Lichtanteile, die ungebeugt die Linse passieren. Das Maximum 0. Ordnung der blauen Kurve, fällt zusammen mit dem Minimum 1. Ordnung der roten Kurve. Sie liegen beide auf der blau gestrichelten Linie. Entsprechend fallen das Maximum 0. Ordnung der roten Kurve und das Minimum 1. Ordnung der blauen Kurve auf der rot gestrichelten Linie zusammen.
Das Rayleigh-Kriterium besagt nun: Die Unterscheidung zweier Bildpunkte ist dann möglich, wenn das Beugungsmaximum 0. Ordnung des einen Punktes mindestens im Beugungsminimum 1. Ordnung des anderen Punktes liegt.
Bei einem Spalt gilt für das Beugungsminimum 1. Ordnung, wie im vorigen Blogbeitrag dargestellt:
sin ∝ = λ/d (2)
Nun haben wir bei einem Mikroskop aber keinen Spalt sondern die Fassung des Objektivs als Strahlenbegrenzung. Bei kreisförmigen Öffnungen liefert die Theorie, die hier nicht näher ausgeführt werden soll:
sin ∝’ ≈ ∝’≈ 1,22 • λ/d (3)
oder wenn man den statt des Durchmessers den Radius r der Linsenfassung einsetzt:
sin ∝’ ≈ 0,61 • λ/r (4).
Wie schon ausgeführt sind die Winkel ∝ und ∝’ wegen der unterschiedlichen Brechungsindizes nicht gleich. Wenden wir das Brechungsgesetz an, so können wir schreiben:
sin ∝’ = noel • sin ∝ (5) (Der Brechungsindex nLuft ist 1).
In Gleichung (4) eingesetzt:
noel • sin ∝ = 0,61 • λ/r (6)
Unser Ziel ist es ja, das x, also den Abstand zwischen den Punkten P1 und P2 unter Berücksichtigung des Abstands a (Entfernung der Punkte von der Linse), zu berechnen. Da der Winkel ∝ sehr klein ist, kann man schreiben:
sin ∝ ≈ x/a (7). In Gleichung (6) eingesetzt:
noel • x/a ≈ 0,61 • λ/r. (7) Nach x aufgelöst ergibt sich:
 (8)
(8)
Der Ausdruck unter dem grossen Bruchstrich entspricht in etwas grober Annäherung der von Ernst Abbe definierten Numerische Apertur NA, so dass wir schreiben können:
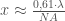 (9)
(9)
Hier nochmal Gleichung (1), etwas anders geschrieben also oben:
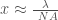 (1)
(1)
Bis auf den Faktor 0,61 stimmen beide Gleichungen überein. Man kommt mit 2 verschiedenen Herleitungen zu sehr ähnlichen Ergebnissen. Wir sehen, je grösser die Numerische Apertur eines Objektivs ist, umso feiner sind die auflösbaren Strukturen.
Im ersten Teil des Blogbeitrags haben wir das Kriterium von Ernst Abbe verwendet, um den kleinstmöglichen Abstand zwischen 2 Punkten zu ermitteln, der in einem optischen Mikroskop noch aufgelöst werden kann. Das Kriterium lautete: „Das Beugungsmaximum 0. Ordnung und mindestens das Beugungsminimum 1. Ordnung müssen durch ein Objektiv fallen, um noch ein strukturiertes Bild zu ergeben.“
Gemäß dem Rayleigh-Kriterium haben wir hergeleitet: “ Zwei Bildpunkte sind dann noch voneinander zu unterscheiden, wenn das Beugungsmaximum 0. Ordnung des einen Bildpunktes mindestens mit dem Beugungsminimum 1. Ordnung des anderen Bildpunktes zusammenfällt.“
Diese Ableitungen, liebe Freunde der Mikrokristalle stammen in wesentlichen Teilen nicht von mir. Ich habe sie einem sehr anschaulichen Video entnommen. Titel: „Mikroskop Teil 4 Auflösungsvermögen Numerische Apertur“. Veröffentlicht auf YouTube von Prof. Dr. Stephan Mueller. Er lehrt an der Fachhochschule Nordwestschweiz. Es gibt eine Reihe sehr interessanter Videos zu Themen der Physik von Stephan Mueller auf YouTube.
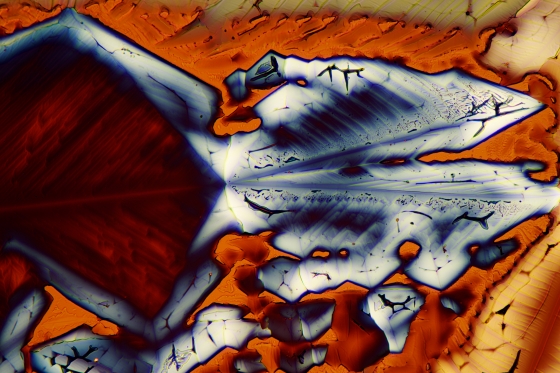
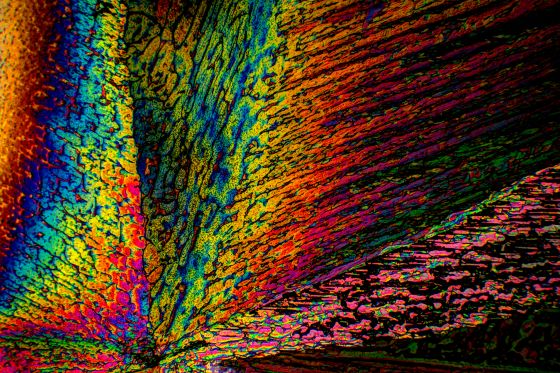
Es ist ja oft ein Problem, geeignete Substanzen für schöne Mikrofotos im polarisierten Licht zu beschaffen. In meinen letzten Blogbeiträgen habe ich einige leicht zu beschaffende anorganische Salze vorgestellt. Heute habe ich mir das Kupfersulfat vorgenommen, das für unsere Zwecke gut geeignet ist.
Hier zwei Fotos von Kupfersulfat:

Mikrokristalle von Kupfersulfat im polarisierten Licht.

Mikrokristalle von Kupfersulfat im polarisierten Licht.
Jeder kennt wohl die Kosmos Baukästen. Es gibt auch einen für Chemie, der eine Reihe von interessanten anorganischen Substanzen enthält. Man kann diese, auch ohne den Chemie-Baukasten zu besitzen, bestellen. Es sind ungefähr 12 verschiedene Stoffe. Auch das Kupfersulfat gehört dazu. Die Chemikalien erhält man bei Kosmos auch als chemischer Laie problemlos.
Soviel für heute, liebe Freunde der Mikrokristalle.
Für meinen nächsten Blogbeitrag werde ich einige der „Kosmos-Substanzen“ testen, und dann darüber berichten.
Bis dahin wünsche ich eine gute Zeit.
H-D-S
p.s. Falls jemand die Zeitschrift FOCUS Gesundheit liest: In der Juni/Juli Ausgabe 2017 findet sich zu einem Artikel über Ibuprofen auf Seite 57 ein Mikrofoto des Wirkstoffs von mir. Wie man den Wirkstoff aus einer Tablette isolieren kann, habe ich in meinem Blogbeitrag „Ibuprofen aus einer Tablette isolieren“, April 2015 beschrieben.