Hallo liebe Freunde der Mikrokristalle,
ich hatte ihn schon angekündigt: den Zuckerersatzstoff Sorbit. Diesen Stoff kann man sich leicht, z.B. aus der Apotheke, beschaffen. In Lebensmitteln wird er als Ersatz für Zucker verwendet.
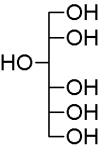
Hier zunächst die chemische Formel:
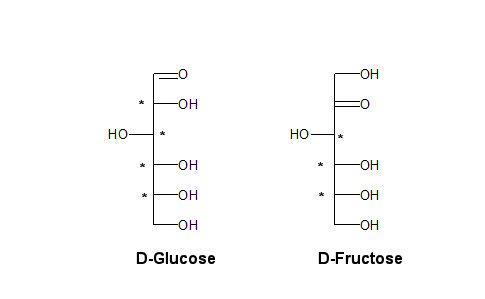
Chemisch ähnelt Sorbit den Zuckern D-Glucose und D-Fructose:
In früheren Blogbeiträgen hatte ich schon über die Geduld berichtet, die man beim Kristallisieren von Zuckern benötigt. Auch Sorbit macht da keine Ausnahme. Der Stoff ist sehr gut löslich in Wasser und Wasser/Alkohol-Gemischen. Gut geeignet ist eine Mischung aus Wasser/Spiritus 1:1 oder besser noch Wasser/Isopropanol 1:1. Man gibt auf einen Objektträger einige Kristalle Sorbit und einen Tropfen Lösungsmittel. Die Kristalle lösen sich schnell auf. Man lässt das Lösungsmittel an einem staubfreien Ort bei Raumtemperatur verdunsten – und siehe da, es passiert nichts -. In aller Regel erhält man keine Kristallisation, auch nicht nach mehreren Tagen Wartezeit. Fast immer ist es erforderlich, die Kristallisation mit Hilfe eines Impfkristalls in Gang zu setzen. Dazu nimmt man die Probe, bei der das Lösungsmittel verdampft ist und versetzt sie mit einem ganz kleinen Sorbitkristall. Schon nach kurzer Zeit, meist nach wenigen Minuten, setzt die Kristallisation ein. Sie beginnt um den Impfkristall herum, wie die folgende Aufnahme zeigt, bei der 2 Impfkristalle zu sehen sind:
Das „Animpfen“ ist im chemischen Labor eine übliche Praxis, um die Kristallisationsneigung von Stoffen, die sonst schwer kristallisieren, zu beschleunigen. Das Animpfen mit einem Impfkristall kann sowohl aus einer übersättigten Lösung, als auch aus einer Schmelze heraus erfolgen. Bei Sorbit funktioniert das ganz hervorragend aus der eingedampften Probe. Aus der Schmelze funktioniert es auch, aber nicht so gut. Bei den folgenden Aufnahmen wurden Sorbit-Kristalle auf einem Objektträger in einem Tropfen Wasser/Isopropanol 1:1 gelöst. Nach dem Verdampfen des Lösungsmittels wurde mit einem kleinen Sorbit-Kristall angeimpft. Für die Aufnahmen wurde zusätzlich zu den Polarisationsfiltern ein λ/4-Plättchen verwendet, da Sorbit farblich sonst nicht allzuviel hergibt.
Soviel für heute, liebe Freunde der Mikrokristalle. In meinem nächsten Blogbeitrag gibt es Mikrokristalle von einem anorganischen Stoff, den man sich sehr leicht, z.B. in der Apotheke, besorgen kann. Es ist Natriumcarbonat, auch Soda genannt.
Bis dahin wünsche ich eine gute Zeit.
H-D-S
p.s. Weihnachten naht, wie wäre es mit einem Kalender voller Mikrokristalle als Geschenk?
Titel: Surreale Farbwelten-Mikrokristalle
Autor: Dieter Schenckenberg
Hier die ISBN-Nummern:
Wandkalender 2017 DIN A4 quer ISBN 978-3-664-84126-4
Wandkalender 2017 DIN A3 quer ISBN 978-3-664-84127-1
Wandkalender 2017 DIN A2 quer ISBN 978-3-664-84128-8
Den Kalender gibt es bei