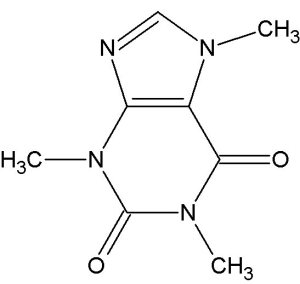
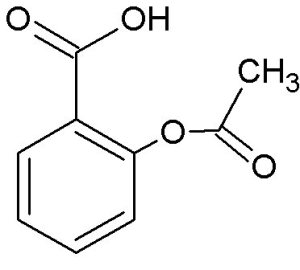
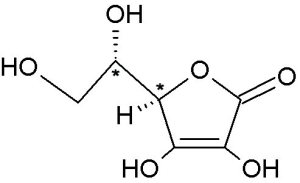
Hallo liebe Freunde der Mikrokristalle,
nicht jeder kann oder mag sich ein hochwertiges und teures Mikroskop leisten. Und vielleicht will man auch erst einmal probieren, ob das Mikroskopieren überhaupt Spaß macht.
Im Internet oder manchmal auch in Fotogeschäften werden immer wieder ältere Mikroskope, manchmal auch sehr namhafter Hersteller, oft preiswert, angeboten. So wurde das hier abgebildete Mikroskop für 50 EURO erworben.
Das Instrument stammt ungefähr aus dem Jahre 1976. Es wurde in der Volksrepublik China gebaut. Es ist ein durchaus hochwertiges Labormikroskop. Die optische Ausstattung besteht aus 3 Objektiven, 5x, 10x und 63x sowie 3 Okularen 5x, 10x und 15x.
Das Stativ ist sehr massiv und mit einem Grob- und Feintrieb ausgerüstet. Wie bei alten Mikroskopen üblich, erfolgt das Scharfstellen über die Bewegung des Tubus. (Moderne Mikroskope bewegen stattdessen den Objekttisch). Der Objekttisch ist ein Drehtisch, wie er normalerweise nur für professionelle Zwecke verwendet wird. Der Kreuztisch wurde vom Autor nachgerüstet, für ca. 20 EURO über Amazon erworben und mit 2-Komponentenkleber auf den Drehtisch aufgeklebt.
Die Beleuchtungseinrichtung bestand ursprünglich aus einem Spiegel und dem Kondensator. Der Spiegel wurde durch eine elektrische Beleuchtung ersetzt:
Die elektrische Beleuchtung läßt sich über einen Dimmer (Baumarkt) regeln. Der Kondensator ist mit einer Aperturblende und einem Filterhalter ausgerüstet. Dieser wurde abgeschraubt. Stattdessen wurde ein drehbares, lineares Polarisationsfilter mit 2-Komponentenkleber angeklebt. So etwas darf man natürlich nur machen, wenn man das Mikroskop ausschließlich als Polarisationsmikroskop benutzen will! Das Heliopan-Polfilter ist auf dem obigen Foto gut zu erkennen. Darüber erkennt man auch den Hebel der Aperturblende.
Soweit die Umrüstung am Mikroskop. Eine leichte Digitalkamera kann man, wie in einem früheren Blogbeitag beschrieben, direkt über einen Adapter, an dem sich ein zweites Polfilter befinden muß, mit dem Tubus verbinden.
Das Scharfstellen über den Mikroskop-Tubus wird aber zum Problem, wenn man eine schwere Spiegelreflex-Kamera verwendet. Keinesfalls sollte man bei diesem Mikroskop-Typ versuchen, die Spiegelreflex-Kamera direkt mit dem Tubus zu verbinden. Das Scharfstellen wird praktisch unmöglich, weil wegen des hohen Gewichts der Kamera der Tubus nach unten gedrückt wird.
Wie man mit einfachen Mitteln eine Spiegelreflex-Kamera an ein Mikroskop auch alten Typs adaptieren kann, wird das Thema meines nächsten Beitags sein.
Bis dahin, liebe Freunde der Mikrokristalle, wünsche ich eine gute Zeit.
H-D-S