Hallo liebe Freunde der Mikrokristalle,
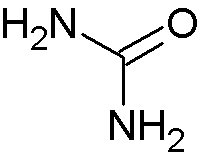
in meinem letzten Blogbeitrag hatte ich die Glutaminsäure angekündigt.
Da es sich heute um meinen 30. Blogbeitrag handelt, habe ich mir aber ein besonderes Thema vorgenommen. Ich möchte am Beispiel der Glutaminsäure beschreiben, warum wir unter dem Mikroskop im polarisierten Licht so eindrucksvolle farbenfrohe Bilder sehen und fotografieren können. Dabei will ich versuchen, das Thema ohne Mathematik und allzuviel Physik und Chemie zu behandeln. Aber es sei gesagt, ganz ohne geht es nicht, das Thema ist etwas sperrig.
Wir wissen: Ein Mikroskop mit Polarisationseinrichtung wird benötigt. Sie besteht aus 2 Polarisationsfiltern. Eines befindet sich unter dem Objekt, das andere darüber.
Mikroskop mit Polarisationseinrichtung.
Das folgende Foto zeigt ein Mikroskop mit solch einer Polarisationseinrichtung:

Mikroskop mit Polarisationseinrichtung.
Ein Polarisationsfilter, der Polarisator, befindet sich über der Beleuchtungseinrichtung. An dem kleinen Hebel kann man das Filter drehen. Oberhalb des Objektivrevolvers sieht man ein zweites Polarisationsfilter, den Analysator. Beide Polarisationsfilter sehen wir in der nächsten Abbildung etwas genauer:

Polarisator und Analysator.
Der Analysator wird in das Mikroskop eingeschoben. Solch eine Anordnung wird „Orientierende Polarisationseinrichtung“ genannt. Man kann damit im Gegensatz zu anspruchsvolleren Einrichtungen keine Polarisationswinkel messen.
Wir wissen also jetzt, ein normales Lichtmikroskop muß durch 2 Polarisationsfilter ergänzt werden, damit wir die schönen farbigen Bilder erhalten. Das hilft uns aber noch nicht viel weiter.
Um zu verstehen, warum die Mikrokristalle so schön farbig werden, wollen wir Schritt für Schritt den Weg des Lichts durch das Mikroskop verfolgen und einige Experimente dazu durchführen. Ich verspreche Euch eine interessante Reise.
Wir beginnen mit der Beleuchtung des Mikroskops und müssen uns zunächst fragen, welche Eigenschaften Licht eigentlich besitzt. Ich will hier kein Physikbuch schreiben und beschränke mich darum auf die für unsere Betrachtung notwendigen Eigenschaften:
1.Licht besitzt Wellencharakter.
Früher hat man angenommen, daß Licht Strahlencharakter besitzt. Viele optische Erscheinungen lassen sich aber nicht mit dem Strahlencharakter erklären. Die Wirkungsweise von Polarisationsfiltern z.B. läßt sich sehr gut beschreiben, wenn man dem Licht Wellencharakter zuordnet, wie wir später sehen werden.
2. Farbloses Licht besitzt ein ausgeglichenes Wellenspektrum.
Das sichtbare Licht besitzt ein Lichtwellenspektrum von ca. 380 nm bis ca. 780 nm. Wenn eine Lichtquelle all diese Wellenlängen aussendet, empfinden wir das Licht als farblos. Auf Sonnenlicht z.B. trifft das zu. Entfernt man aus dem Lichtspektrum eine Wellenlänge, z.B. die der Farbe blau, so empfinden wir das Licht in der Komplementärfarbe gelb.
3. Lichtwellen schwingen in verschiedenen Ebenen.
Lichtwellen schwingen in verschiedenen Ebenen. Es gibt dabei keine bevorzugte Schwingungsebene, alle Ebenen sind vorhanden.Die folgende Skizze zeigt, als Ausschnitt aus dem gesamten Ebenenspektrum, eine horizontal und eine vertikal schwingende Welle.
 Auch die Lampe in unserem Mikroskop liefert ein Licht, das in allen möglichen Ebenen schwingt und dessen Wellenspektrum ziemlich ausgeglichen ist.
Auch die Lampe in unserem Mikroskop liefert ein Licht, das in allen möglichen Ebenen schwingt und dessen Wellenspektrum ziemlich ausgeglichen ist.
Wir müssen für unsere weiteren Betrachtungen die beiden Aspekte, Schwingungsebenen, Wellenspektrum besonders im Auge behalten.
Starten wir unser erstes Experiment: Auf einem Objektträger habe ich Glutaminsäure-Kristalle gezüchtet. Wir legen sie ohne Polarisationsfilter unter das Mikroskop:

Glutaminsäure-Kristall ohne Polarisationseinrichtung
Belichtungszeit 1/13 s
Der Glutaminsäure-Kristall wirkt völlig unspektakulär, Farben sind kaum sichtbar.
Jetzt legen wir den Polarisator auf die Lampe des Mikroskops und wiederholen die Aufnahme mit der gleichen Belichtungszeit von 1/13 s.

Glutaminsäure_Kristall mit Polarisator
Belichtungszeit 1/13 s
Auch hier sind kaum Farben erkennbar. Die Aufnahme ist stark unterbelichtet. Was ist passiert? Hier kommen wir zur Wirkungsweise von Polarisationsfiltern.
Polarisationsfilter.
Betrachten wir nochmal die obige Skizze mit den Wellen. Daneben sind 2 Gitter gezeichnet. Sie sollen das Prinzip von Polarisationsfiltern darstellen. Polarisationsfilter besitzen solche Gittereigenschaften. Bei dem einen Gitter verlaufen die Gitterlinien horizontal. Dieses Filter läßt nur Lichtwellen die in horizontaler Richtung schwingen passieren. Alle anderen Lichtwellen werden gesperrt. Dreht man das Filter um 90 Grad, haben wir vertikale Gitterlinien. Entsprechend läßt das untere Filter nur vertikal schwingende Lichtwellen durch. Legt man 2 Polarisationsfilter übereinander, und zwar so, daß die Gitter gekreuzt sind, werden keine Lichtwellen mehr durchgelassen.
Wir schauen uns das auf den folgenden Bildern an:
Im ersten Bild sehen wir eine Polarisationsfilterfolie, auf der ein zweites Polarisationsfilter liegt. Die Gitter beider Filter sind gleich ausgerichtet. Somit kann Licht einer Schwingungsebene die Filter passieren.

Zwei Polarisationsfilter mit gleicher Gitterorientierung.
In der nächsten Aufnahme ist die untere Polarisationsfilterfolie um 90 Grad gedreht. Die Gitter sind jetzt gekreuzt und lassen kein Licht mehr passieren. Verwendet man hochwertige Polarisationsfilter und kreuzt sie, werden über 90% der Lichtwellen zurückgehalten.

Unteres Polarisationsfilter um 90 Grad gedreht, die gekreuzten Filter lassen kein Licht mehr passieren.
Soweit der kleine Einschub zu Wirkungsweise von Polarisationsfiltern. Kommen wir zurück zu unserm Glutaminsäure-Kristall.
Jetzt ist auch klar, was bei der zweiten Kristall-Aufnahmen, die mit dem Polarisator über der Mikroskoplampe aufgenommen wurde, passiert ist. Der Polarisator hat nur Lichtwellen einer Schwingungsebene passieren lassen. Man sagt, das Licht wurde linear polarisiert. Da nur ein Teil des Lampenlichts durch das Gitter des Polarisators gegangen ist, wurde die Aufnahme bei gleicher Belichtungszeit wie ohne Filterung stark unterbelichtet.
Trotz Polarisator haben wir aber noch kein farbiges Bild erhalten. Polarisiertes Licht alleine schafft also noch nicht die wunderschönen farbigen Aufnahmen.
Schieben wir nun das zweite Polarisationsfilter, den Analysator in den Strahlengang und sorgen dafür, das die Gitter gekreuzt sind. Die folgende Aufnahme wurde mit den gekreuzten Filtern aufgenommen.

Glutaminsäure-Kristall zwischen gekreuzten Poarisationsfiltern.
WOW, jetzt haben wir es. Sind also die beiden gekreuzten Polarisationsfilter entscheidend für das farbige Bild?
Merkwürdig, wir haben doch gerade festgestellt, das gekreuzte Polarisationsfilter Lichtwellen vollständig sperren. Warum sehen wir dann plötzlich den farbigen Kristall? Schauen wir das Bild genau an. Um den Kristall herum ist alles schwarz. Das war zu erwarten, denn die beiden Polarisationsfilter sind gekreuzt und sperren das Licht vollständig. Der Kristall ist aber sichtbar. Das ist nur möglich, wenn er die Ebene des polarisierten Lichtes gedreht hat. Soweit so gut, aber wenn er nur die Ebene des polarisierten Lichts gedreht hätte, warum ist er dann auch noch zusätzlich farbig? Fragen über Fragen.
Machen wir ein zweites Experiment: Ich habe Kochsalz Kristalle (NaCl) auf einem Objektträger gezüchtet. Sie sind nicht sehr schön, aber hier geht es ja mehr um die Funktion. Zunächst eine Aufnahme ohne Polarisationsfilter.

Kochsalz (Natriumchlorid) ohne Polarisationsfilter.
Und jetzt die gleiche Aufnahme mit gekreuzten Polarisationsfiltern:

Kochsalz-Kristalle mit gekreuzten Polarisationsfiltern.
Dieses Ergebnis entspricht unseren Erwartungen. Bei gekreuzten Polarisationsfiltern wird der Lichtdurchgang vollständig gesperrt, wir sehen praktisch nichts. Im Gegensatz zur Glutaminsäure, ist auch kein Kristall zu sehen.
Was schließen wir aus den bisherigen Experimenten? Offensichtlich gibt es Kristalle, welche die Ebene des polarisierten Lichtes drehen können, und somit auch bei gekreuzten Filtern sichtbar werden. Darüber hinaus sind sie sogar noch farbig. Andere Kristalle wiederum besitzen diese Eigenschaften nicht. Wir müssen uns also etwas näher mit den Eigenschaften von Kristallen befassen.
Ich möchte an dieser Stelle nicht tiefer in den chemisch/physikalischen Aufbau von Kristallen einsteigen, (vielleicht in einem späteren Blogbeitrag), nur soviel: Es gibt zwei prinzipielle Arten von Kristallen:
1.Isotrope Kristalle.
Natriumchlorid (Kochsalz) ist ein Beispiel eines isotropen Kristalls. Es kristallisiert in Form von Würfeln. Wenn man elektrischen Strom durch den Würfel leitet um die Leitfähigkeit von Natriumchlorid zu messen, ist es egal, ob man z.B. in horizontaler oder in vertikaler Richtung misst. Die elektrische Leitfähigkeit ist bei Natriumchlorid unabhängig von der Durchleitungsrichtung.

Bei isotropen Kristallen verhalten sich Lichtwellen unabhgängig von der Durchleitungsrichtung.
Auch wenn linear polarisiertes Licht Natriumchlorid-Kristalle passiert, verhält es sich von der Durchgangsrichtung völlig unabhängig. Kristalle, deren Moleküle oder Ionen sehr regelmäßig angeordnet sind, zeigen diese Eigenschaft. Stoffe, die sich optisch in allen Richtungen gleich verhalten, nennt man isotrop.
2. Anisotrope Kristalle.
Die Kristalle der Glutaminsäure und sehr viele andere Kristalle zeigen ein anderes Verhalten. Bei ihnen ist es nicht egal, ob die Durchleitungsrichtung horizontal oder vertikal oder irgend eine andere Richtung ist. Die Ursache liegt im chemisch/physikalischen Aufbau der Kristalle begründet. Je nach Durchleitungsrichtung erhält man ein anderes Resultat. Kristalle deren optisches Verhalten richtunsabhängig ist, nennt man anisotrop.
Wenn linear polarisiertes Licht einen Glutaminsäure-Kristall passiert, wird es je nach Eintrittsrichtung aufgespalten. Ein Teil passiert den Kristall unverändert, bei dem anderen Teil wird die Schwingungsebene um 90 Grad gedreht und auch die Durchgangsrichtung wird geändert. Verfolgen wir den Weg einer Welle:

Aufspaltung und Drehung einer Lichtwelle im anisotropen Medium
Die schwarze Teilwelle passiert den Kristall unverändert, die rote Teilwelle ändert ihre Richtung und wird um 90 Grad gedreht. Durch die Richtungsänderung wird der Weg der roten Welle länger, es tritt ein Gangunterschied zwischen beiden Teilwellen ein, symbolisiert durch den kürzeren roten Strich.
Kehren wir an dieser Stelle zu unserem zweiten Foto, der unterbelichteten Aufnahme des Glutaminsäure-Kristalls zurück. Hier haben wir die Situation, wie gerade beschrieben. Beim Durchtritt durch den anisotropen Glutaminsäure-Kristall werden die Lichtwellen aufgespalten. Ein Teil der Wellen passieren den Kristall unverändert, bei dem anderen Teil wird die Schwingungsebene um 90 Grad gedreht und der Weg durch den Kristall wird länger. Es entsteht ein Gangunterschied.
Jetzt kommt das zweite Polarisationsfilter, der Analysator ins Spiel. Wir haben gesehen, das erst mit dem Zuschalten des Analysators das Bild bunt wird. Wie ist das zu erklären?
Es bleibt uns nicht erspart, liebe Freunde der Mikrokristalle, um eine Erklärung dafür zu finden, müssen wir noch ein weiteres Verhalten von Lichtwelle besprechen, die Interferenz.
Interferenz
Wenn wir an einem Teich mir ruhiger Wasseroberfläche stehen und werfen, sagen wir im Abstand von einem Meter, 2 Steine gleichzeitig ins Wasser, dann sehen wir, wie sich 2 Wellen ausbreiten und sich dann überlagern. Bei der Überlagerung von Wellen kommt es zu teilweiser Abschwächung, Auslöschung und Verstärkung. Um das zu verstehen, kommen wir zurück auf die Skizze mit dem Gangunterschied und der Ebenendrehung von Wellen.
Wir haben gesehen, daß Lichtwellen bei dem Aufspalten ihre Richtung ändern, einen längeren Weg durch den Kristall zurücklegen müssen und daher auch zeitlich verzögert aus dem Kristall wieder austreten. Sie erleiden damit einen Gangunterschied. Der Gangunterschied ist dafür verantwortlich, daß sich Wellen beim Überlagern ausgelöscht werden können, wie die folgende Skizze verdeutlichen soll.

Totalauslöschung zweier überlagerter Wellen.
Wir sehen zwei überlagerte Wellen. Hier beträgt der Gangunterschied der roten Welle gegenüber der schwarzen eine halbe Wellenlänge. Wo die schwarze Welle ihe maximale Auslenkung erreicht, liegt das Minimum der roten Welle. Addiert löschen sie sich aus. Abhängig vom Gangunterschied können auch nur Abschwächungen oder auch Verstärkungen eintreten. Das ganze nennen wir Interferenz. Wellen können aber nur interferieren, wenn sie etwa die gleiche Wellenlänge besitzen und in einer Ebene schwingen.
Aufgabe des Analysators
Nachdem die Lichtwellen im anisotropen Glutaminsäurekristall aufgespalten wurden, Richtungsänderungen und Ebenendrehungen erfahren haben, treten sie nun durch das zweite Polarisationsfilter. Hier werden aber nur Lichtwellen gleicher Schwingungsebene durchgelassen. Es sind dies die Lichtwellen, die die gleiche Orientierung wie der Analysator besitzen. Und da sie nun alle in einer Ebene schwingen, Gangunterschiede besitzen, können sie auch interferieren. Dabei werden manche Wellen vollkommen ausgelöscht, andere abgeschwächt oder verstärkt. Das Lichtspektrum ist jetzt nicht mehr ausgeglichen, was ja die Voraussetzung für farbloses Licht ist, außerdem ist es um 90 Grad gedreht. Der Kristall wird sichtbar und wir sehen seine prächtigen Interferenz-Farben.
Es war ein ziemlich langer Weg bis hierhin, liebe Freunde der Mikrokristalle, darum kommen zur Entspannung jetzt noch zwei Fotos von Glutaminsäure-Kristallen. Ganz nebenbei, ich habe hier nicht die optische Aktivität erwähnt, denn Glutaminsäure ist eine optisch aktive Verbindung. Für unsere Betrachtung hätte die Einbeziehung der optischen Aktivität die Sache nur unnütz verkompliziert.

Glutaminsäure-Mikrokristall im polarisierten Licht.

Glutaminsäure-Mikrokristall im polarisierten Licht.
Soviel für heute, liebe Freunde der Mikrokristalle. Im nächsten Beitrag gibt es eine Vergleich einiger optisch aktiver Kristalle mit optisch inaktiven.
Bis dahin wünsche ich eine gute Zeit.
H-D-S